Biologie Zellen steuern mit Licht – und Liebe
In der noch recht jungen Disziplin der Optogenetik geht es um das An- und Abschalten bestimmter Prozesse in Zellen. Und zwar mithilfe von Licht. Dank eines neuen „Proteinshuttles“ können Proteine nun gezielt in den Zellkern gesteuert werden – und wieder hinaus. Wie das funktioniert erklärt Biologe Dominik Niopek.
„Na, spielst du wieder den DJ?“ Meine Kollegin lacht, und ich kann es verstehen. Es muss schon eigenartig anmuten, wie ich im weißen Kittel im vollkommen abgedunkelten Labor in einen Brutschrank starre – und grelle Blitze mein Gesicht in neonblaues Licht tauchen. Im Inneren des Schranks befinden sich Kulturen menschlicher Nierenzellen – sie sind es, auf die ich die Lichtblitze richte. Normalerweise reagieren solche Zellen natürlich nicht auf Beleuchtung, diese aber verfügen über künstliche lichtempfindliche Proteine. Das Forschungsfeld, in dem ich arbeite, ist die Synthetische Biologie. Ich entwickle molekulare Werkzeuge, um Proteine zu kontrollieren und damit gezielt das Verhalten von Zellen zu steuern.
Beim Begriff „steuern“ denken die meisten an Elektronik, Maschinen und Ingenieure und weniger an Proteine, Zellen und Biologen. Tatsächlich lässt sich die Synthetische Biologie als die Ingenieursdisziplin unter den Biowissenschaften verstehen. Es geht darum, Konzepte aus dem Maschinenbau, der Elektrotechnik und Informatik zu übernehmen, um sie auf lebende Systeme zu übertragen. Das ermöglicht einerseits ein immer detaillierteres Verständnis der komplexen Prozesse, die allem Lebenden – also selbst einfachsten Mikroorganismen – zugrunde liegen. Andererseits gibt es bereits jetzt vielfältige Anwendungen der Synthetischen Biologie. So helfen schon heute genetisch umprogrammierte Bakterien und Hefen beispielsweise bei der Herstellung von Medikamenten gegen Malaria – oder der Produktion von Biodiesel.
Aber Zellen zu steuern, ist kein einfaches Unterfangen. Wie soll man etwas lenken, das seine ganz eigenen Signale hat? Der Ingenieur benutzt hierfür einen Sender und den dazu passenden Empfänger. Die Sache mit dem Sender ist relativ einfach. Wir verwenden Licht. Es lässt sich leicht ein- und ausschalten und hat keine Nebenwirkungen. Im Prinzip kommt eine einfache Taschenlampe in Frage, noch besser aber eignen sich LEDs oder Laser, die sich präzise auf einzelne Zellen ausrichten lassen. Schwieriger ist es mit dem Empfänger, der ja in der Zelle selbst sitzen muss. Er muss das Signal nicht nur auffangen, sondern es auch auf ein Protein übertragen und dessen Aktivität beeinflussen. Nur dann kann die Zelle mit dem Befehl etwas anfangen.
LOV heißt die Lösung dieses Problems. Das klingt im Englischen wie love, (Liebe), ist aber ein Akronym und steht für Light (Licht), Oxygen (Sauerstoff) und Voltage (Spannung), drei Reize, auf die LOV-Proteine reagieren. In seiner natürlichen Umgebung im Hafer ist das LOV-Protein Teil des Sonnenlicht-Sensors Phototropin. Bei Dunkelheit liegt das LOV-Protein als kompakte und starre Struktur vor und blockiert die Aktivität des Phototropins – wie die Sperre eines Zahnrads. Fällt jedoch blaues Licht auf den Komplex, entspannt sich die Struktur, aktiviert das Phototropin und setzt eine ganze Kaskade von Ereignissen in Gang. Die Folge: Die Haferpflanze richtet sich zur Lichtquelle aus. Das LOV-Protein ist sozusagen das Auge des Hafers.
Genetisch umprogrammierte Bakterien produzieren Medikamente gegen Malaria – oder Biodiesel.
Genau diese Aufgabe soll es auch in Zellen von Säugetieren übernehmen. Dann könnte man es mithilfe von Lichtblitzen dazu bringen, die Zelle gezielt Dinge tun zu lassen – zum Beispiel bestimmte Stoffe produzieren. Die Frage ist nur, wie man dem Protein und der Zelle beibringen soll, als neues Team zusammenzuwirken. Dazu muss man wissen: Was eine Zelle genau macht, hängt nicht nur davon ab, welche Proteine in ihr vorliegen, sondern mindestens ebenso davon, wo sich diese Proteine zu einem bestimmten Zeitpunkt innerhalb der Zelle befinden. So können beispielsweise Proteine, die als Genschalter fungieren, nur im Zellkern ihrer Aufgabe nachkommen, also dort, wo die Erbinformation gespeichert ist. Viele Enzymproteine arbeiten hingegen ausschließlich im Zellplasma oder in spezialisierten Zellorganellen, zum Beispiel in den „Kraftwerken der Zelle“, den Mitochondrien.

Zellen kontrollieren die Aktivität ihrer Proteine daher häufig, indem sie diese einfach an ihren Wirkungsort transportieren oder von dort entfernen. Das geht schnell und kostet weniger Ressourcen, als wenn die Proteine ständig neu synthetisiert und gleich wieder abgebaut werden müssten.
Auf der Basis dieses natürlichen Schaltprozesses wollte ich das LOV-Protein derart modifizieren, dass ich es als universellen Schalter in allen Arten von Zellen einsetzen kann. Mithilfe gentechnischer Methoden versah ich es zunächst mit einer Art Adressetikett, das dem zelleigenen Transportsystem vorgaukelt, das LOV-Protein sei eine wertvolle Fracht, die rasch in den Zellkern hinein- oder aus ebendiesem hinausbefördert werden sollte. Im Dunkeln ist dieses Etikett unsichtbar, und es passiert nichts. Erst durch Bestrahlung mit blauem Licht kommt es zum Vorschein, und der Transport kann losgehen. Hängt man ein derart modifiziertes LOV-Protein nun an beliebige zelleigene Proteine, sollte sich deren Bewegung mit blauem Licht von außen steuern lassen: ein synthetischer lichtabhängiger „Proteinshuttle“: Blaues Licht an bedeutet „Rein in den Zellkern!“, Licht aus heißt: „Raus aus dem Zellkern!“ Soweit die Theorie.
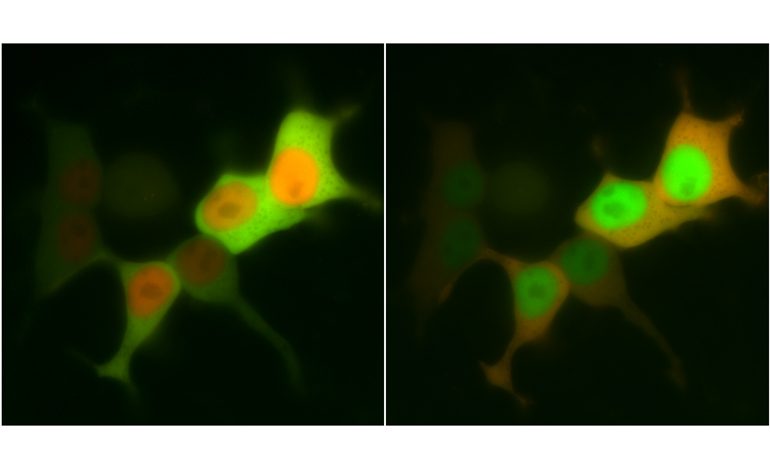
Der Praxistest erfolgte unter dem Mikroskop. Dort konnte ich die Bewegung von Proteinen in einzelnen Zellen live verfolgen. Ich koppelte das modifizierte LOV-Protein an ein sogenanntes Reporterprotein, das mir mit seinem roten Leuchten stets verriet, wo in der Zelle es sich gerade befand. Dieses Tandem führte ich in menschliche Zellen einer Kultur ein und begann mit meinen blauen Lichtblitzen. Tatsächlich bewegten sich die Proteine in dem Rhythmus, den ich ihnen mit meinen LEDs vorgab. Schaltete ich das blaue Licht an, wanderte das Reporterprotein binnen weniger Sekunden vom Zellplasma in den Zellkern, bis dieser schließlich tiefrot leuchtete. Schaltete ich das Licht wieder aus, zog sich das Reporterprotein ins Zellplasma zurück. Dieser Proteinshuttle funktionierte dann nicht nur in kultivierten menschlichen Zellen, sondern auch in Hefen und sogar in lebenden Zebrafischembryonen.
Aber lässt sich mit meinem Protein-shuttle auch das Verhalten von Zellen steuern? Um diese Frage zu beantworten, ersetzte ich das rote Reporterprotein durch Genschalter, die die Zellteilung einleiten oder bei gefährlichen Erbgutschäden, etwa infolge von radioaktiver Strahlung, aktiviert werden.
Gemeinsam mit meinen Kollegen brachte ich diese Genschalter mit LOV-Zusatz erneut in menschliche Zellkulturen ein. Beleuchtete ich sie mit blauem Licht, teilten sich die Zellen oder starteten genetische Reparaturprogramme, die im Menschen einer Krebsentstehung entgegenwirken. Der von mir entwickelte Proteinshuttle ist mittlerweile in über 20 Forschungslaboren weltweit im Einsatz. Erst vor kurzem wurde er von Nathan Sherers Forschungsgruppe am Carbone Cancer Center der University of Wisconsin (USA) verwendet, um ein wichtiges Protein des AIDS-auslösenden HI-Virus zu studieren.
Blaues Licht an bedeutet "Rein in den Zellkern!", Licht aus heißt: "Raus aus dem Zellkern!"
Wie jedes andere Werkzeug hat aber natürlich auch mein modifiziertes LOV-Protein seine Grenzen. So eignet es sich zwar bestens für die Steuerung frei beweglicher Proteine in Zellkulturen. Hin zu einer lichtgesteuerten Krebstherapie im Menschen beispielsweise ist es aber noch ein weiter Weg. Doch weltweit tüfteln die Bio-Ingenieure längst an entsprechenden Verfahren – und die Natur hält sicherlich noch manch überraschende Lösung für sie bereit!
Hintergrund
Die ferngesteuerte Maus
Eine kurze Geschichte der Optogenetik
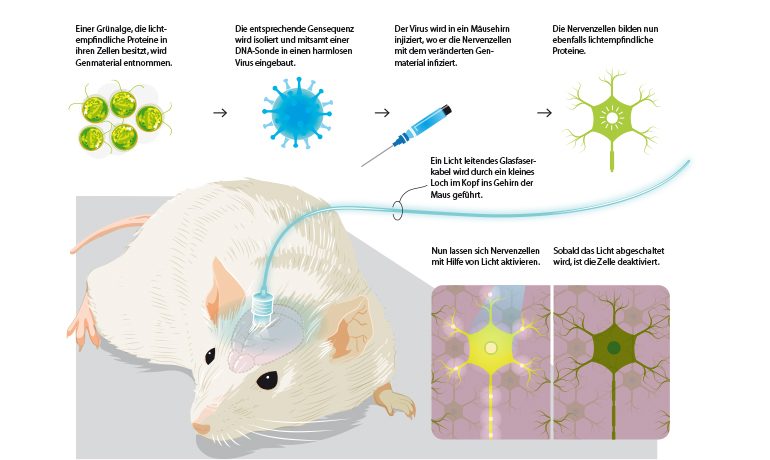
Algen gehören zu den ältesten Lebewesen auf der Erde – und seit Jahrmilliarden „wissen“ sie, wie sie sich zu ihrer Energiequelle, der Sonne, ausrichten. Dazu verfügen sie über bestimmte lichtempfindliche Proteine. Ein Team um Peter Hegemann von der Berliner Humboldt-Universität hatte Ende der 1990er-Jahre die Grünalge Chlamydomonas erforscht und war auf sogenannte Kanal-Rhodopsine gestoßen. Diese Proteine wirken in bestimmten Zellen wie Schalter, die auf Licht reagieren.
2004 gelang es Karl Deisseroth von der Stanford University und seinem Team, das Gen dieser Algenproteine in Nervenzellen einer Maus einzubauen, sodass diese das Protein produzierten – und somit lichtempfindlich wurden. Mithilfe eines in die Hirnregion eingeführten Glasfaserkabels konnten diese Nervenzellen nun aktiviert oder deaktiviert werden. Das Ergebnis: Die Maus lief – ferngesteuert durch Lichtimpulse – im Kreis herum, stoppte und rannte wieder los. Deisseroth gilt seither als der Begründer der Optogenetik, also der Steuerung genetisch veränderter Zellen mithilfe von Licht.
Mittlerweile ist das Verfahren weltweit verbreitet. Gleichwohl könnte die Optogenetik gerade in der Therapie psychischer Erkrankungen einmal eine große Rolle spielen. So konnten Deisseroth und sein Team bereits Mäusen die Angst vor anderen nehmen. Verhielten sie sich fremden Tieren gegenüber zunächst zögerlich, wurden sie mutig und gingen auf diese zu, sobald das Licht anging.
Da die Nervenzellen im Gehirn dafür gentechnisch verändert werden müssen, gibt es hinsichtlich eines Einsatzes beim Menschen ethische und moralische Bedenken. Die neue Methode könnte jedoch die Grundlage sein für neuartige Therapien. Wann und wie die Patienten davon profitieren, ist indes noch ungewiss.
von Joachim Schüring