Biologie Der Vorteil des Fischauges
Wenn wir älter werden, wird die Sicht schlechter. Der Grund: Die Sinneszellen in unserer Netzhaut verschleißen im Laufe des Lebens. Bei Fischen hingegen sorgen Stammzellen für die ständige Erneuerung. Auch in unseren Augen gibt es Stammzellen. Leider schlafen sie
Die Licht- und Farbreize, die auf die Netzhaut unserer Augen treffen, werden dort in elektrische Signale umgewandelt und über den Sehnerv ans Gehirn weitergeleitet. Rund 16 Millionen solcher „Informationsbits“ verarbeitet unser Hirn – in jeder Sekunde. In der Netzhaut – oder Retina – befindet sich ein komplexes Geflecht von Sinneszellen, die bemerkenswert langlebig sind: Sie begleiten uns von der Wiege bis zur Bahre. Wenn sie allerdings zu Schaden kommen – etwa durch ultraviolette Strahlung oder infolge von Erkrankungen wie Diabetes –, kann der Körper sie nicht ersetzen.
Schon seit Langem suchen Forscherinnen und Forscher deshalb nach geeigneten Therapien und setzen dabei auch auf Stammzellen. Das sind Körperzellen, die sich noch in verschiedene Zelltypen oder Gewebe ausdifferenzieren können – also beispielsweise zu Haut-, Muskel- oder Nervenzellen werden können. Schädigungen der Netzhaut, so die Hoffnung, könnten damit vielleicht einmal geheilt werden.
Die Netzhaut besteht im Wesentlichen aus drei Teilen: dem eigentlichen Nervengewebe, einer umgebenden schwarzen Zellschicht (Pigmentepithel) und einem angrenzenden dünnen Häutchen, der „blinden Netzhaut“ (non-visual retina). Alle drei Bestandteile zusammen ermöglichen uns das Sehen: Das Nervengewebe fängt Licht ein und gibt die Information weiter an das Gehirn, das Pigmentepithel schattet reflektiertes Licht ab und versorgt das Nervengewebe mit Nährstoffen. Die blinde Netzhaut hingegen verdankt ihren Namen ihrer indirekten Rolle: Sie regelt die Pupillenöffnung und hält die Flüssigkeit im Augapfel klar.
Bei Säugetieren konnten Forscherinnen und Forscher bisher nur in jener blinden Netzhaut Stammzellen entdecken – mussten aber feststellen, dass sich diese Stammzellen zeitlebens im Zustand des Schlafes befinden, also nicht aktiv sind.

Bei Fischen ist dies hingegen ganz anders: Sie verfügen in ihrer Netzhaut über lebenslang aktive Stammzellen – und zwar in allen drei Teilen der Netzhaut: im Nervengewebe, im Pigmentepithel und in der blinden Netzhaut. Diesen Stammzellen ist es zu verdanken, dass das Auge im Laufe der Entwicklung vom Jung- zum Alttier mitwächst. Und dabei stellt sich eine wichtige Frage: Wie ist sichergestellt, dass in allen drei Teilen immer genau so viele Zellen gebildet werden, die eine funktionstüchtige Netzhaut braucht? Oder genauer: Wie stimmen sich die Zellen untereinander ab? Denn das ist wichtig: Gerät das Zellwachstum außer Kontrolle, könnten krebsartige Geschwüre die Folge sein.
Antworten auf diese Frage erhofften wir uns von dem nur etwa dreieinhalb Zentimeter langen japanischen Reisfisch Medaka (Oryzias latipes). Um das Stammzellenwachstum in dessen Netzhaut zu erforschen, mussten wir zunächst einen Trick anwenden. Weil sich die Aktivität von Stammzellen nämlich nicht direkt beobachten lässt, aktivierten wir in ihnen gezielt ein Gen, das die Produktion eines leuchtenden Proteins veranlasste. Dieses Gen wurde bei der Zellteilung an die Tochterzellen vererbt, die sich nun ebenfalls durch das leuchtende Protein verrieten.
In den Netzhautpräparaten erwachsener Fische konnten wir nun zahlreiche dieser farbigen Zellen erkennen. Unser Ziel war nun, die einzelnen Zellgenerationen zu identifizieren. Wir mussten die Teilungen nachvollziehen, also gleichsam Ahnenforschung mit Zellen betreiben.
Da sich die zeitliche Entwicklung der Stammzellenfamilien nicht im Tierpräparat beobachten lässt, bedienten wir uns eines mathematischen Modells als Grundlage für eine Computersimulation. Die simulierte Netzhaut bildete eine halbkugelförmige Oberfläche, auf der die virtuellen Zellen dicht an dicht wie in einem Wabenmuster gepackt waren. Aus früheren Studien wussten wir, dass sich nur die Zellen am Rand der Halbkugel teilen durften: die virtuellen Stammzellen. Wir fütterten dieses Modell also mit unseren Beobachtungen unter dem Mikroskop und veränderten die Parameter derart, dass die Simulation die Beobachtungen gut wiedergab. So konnten wir auf der Basis von wenigen Präparaten gleichsam einen Film über das Stammzellenwachstum im Laufe des Fischlebens erstellen.
Dieser „Zellstammbaum“ offenbarte, dass die Stammzellen im Nervengewebe das Wachstum dominieren und den Stammzellen im Pigmentepithel signalisieren, wann sie aktiviert werden und neue Zellen bilden sollen. Die Stammzellen des Nervengewebes geben also offenbar das Wachstumstempo vor, während die Stammzellen des Pigmentepithels sich diesem Tempo anpassen.
Auch auf die zentrale Frage nach der Kommunikation zwischen den Zellen innerhalb des Pigmentepithels lieferte die Simulation einen wichtigen Hinweis: Im Pigmentepithel dauerte es viel länger, bis die Stammzellen neue Tochterzellen erzeugten. Dafür gab es zwei mögliche Gründe: Entweder waren die Zellen von Natur aus weniger ertragreich oder es gab schlafende Stammzellen, die durch ihre Untätigkeit den Durchschnitt verzerrten.
Um der Sache auf den Grund zu gehen, wendeten wir uns wieder dem Reisfisch zu und markierten teilungsfähige Zellen im Pigmentepithel. Dazu verwendeten wir eine farbige Chemikalie, die von den Zellen als natürlicher DNA-Baustein erkannt wird. Überraschenderweise stießen wir dabei auf teilungsfähige Zellen, die aber gar nicht über die notwendigen Proteine für den Teilungsprozess verfügten. Dies mussten die schlafenden Stammzellen sein. Allerdings konnten diese – anders als im Säugetierauge – erwachen und neue Tochterzellen erzeugen.
So wurde das Bild immer klarer: Stammzellen des Nervengewebes konnten nach Bedarf neuen Raum erschaffen. In dem Fall wuchs die Oberfläche unserer simulierten Netzhauthalbkugel, während die Stammzellen des Pigmentepithels nur um den bestehenden Platz wetteiferten. Zellen, die keinen Platz ergattern konnten, schliefen ein, bis neuer Wohnraum vorhanden war. So wuchs die Zellbevölkerung im Nervengewebe Hand in Hand mit der im Pigmentepithel. Durch diese gemeinsame Strategie wuchsen beide immer in abgestimmtem Tempo – nicht zu viel und nicht zu wenig.
Und was hat es mit der blinden Netzhaut auf sich? Das unscheinbare Häutchen grenzt sowohl ans Nervengewebe als auch ans Pigmentepithel. Und: Anders als im Fischauge finden sich bei Säugetieren nur hier (inaktive) Stammzellen.
Als wir uns nun diese blinde Netzhaut beim Reisfisch anschauten, machten wir eine überraschende Entdeckung. In Jungtieren befinden sich die Stammzellen in einem Zustand der Inaktivität. Sie schlafen. Erst im Laufe der Zeit wachen sie auf und werden aktiv – ihre Tochterzellen siedeln über die Grenze der blinden Netzhaut hinweg ins Pigmentepithel und ins Nervengewebe über. Dort tun sie, was Stammzellen tun: Sie differenzieren sich in die in Pigmentepithel und Nervengewebe benötigten funktionalen Zellen.
Wir wissen nun also erstens, wie sich die Stammzellen in den Netzhautgeweben derart steuern, dass das Wachstum synchron verläuft – für die Funktion des Auges ist dies unerlässlich. Zweitens verfügt die blinde Netzhaut des Reisfisches über Stammzellen, die im Verlauf des Lebens sowohl zum Pigmentepithel als auch zum Nervengewebe beitragen können. Und so steht am Ende unserer Arbeit die große Frage, warum die Stammzellen in der blinden Netzhaut bei Fischen im Lauf des Lebens aktiv werden, während das bei Säugetieren offenbar nicht der Fall ist. Welcher Mechanismus ist für die Aktivierung erforderlich? Und: Ist es auf irgendeine Weise möglich, die Stammzellen im Säugetier und damit auch bei uns Menschen zu aktivieren? Noch sind wir weit davon entfernt, diese Fragen beantworten zu können. Doch sind wir ziemlich sicher, dass in diesen schlafenden Stammzellen in unseren Augen einiges Potenzial steckt.
Große Hoffnungen
Weltweit wird an Therapien mit Stammzellen geforscht. Doch es bleibt kompliziert
Das Prinzip der Therapie mit Stammzellen klingt so vielversprechend. Denn mithilfe dieser Zellen, die noch die Fähigkeit haben, sich in alle Zelltypen eines Organismus zu entwickeln, müsste man doch eine Vielzahl von Krankheiten ein für alle Mal heilen können. Doch so einfach ist das nicht, tatsächlich gibt es in der Praxis bisher nur wenige Anwendungen.
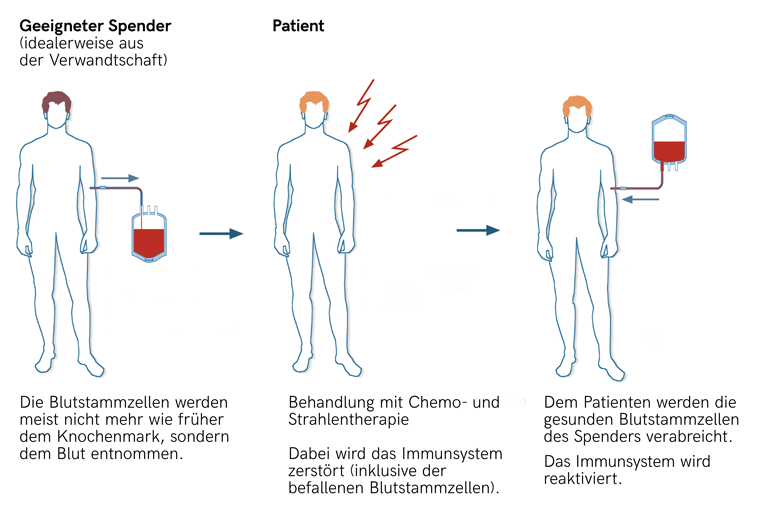
Die am weitesten verbreitete – und auch älteste – Stammzelltherapie richtet sich gegen Erkrankungen des Blutes, Leukämie etwa. Dabei werden Blutstammzellen geeigneter Spenderinnen und Spender transplantiert. Allerdings müssen dazu im Knochenmark der Erkrankten zunächst praktisch alle blutbildenden Zellen zerstört werden. Auch das Abwehrsystem muss abgeschaltet werden, damit die transplantierten Spenderstammzellen nicht gleich wieder abgestoßen werden.
Seit rund 50 Jahren profitieren auch Menschen mit lebensbedrohlichen Verbrennungen von Stammzelltherapien. Dabei wird mithilfe von Hautstammzellen im Labor neue Haut gezüchtet und anschließend transplantiert. Seit Kurzem ist in Europa auch eine stammzellbasierte Behandlung von Verletzungen der Hornhaut des Auges zugelassen. Davon profitieren insbesondere Patientinnen und Patienten, deren Hornhaut bei einem Unfall verätzt wurde.
Es gibt Studien, die perspektivisch auf den erfolgreichen Einsatz von Stammzellen bei neurologischen Erkrankungen wie der Parkinson-Krankheit hoffen lassen. Auch Schädigungen des Herzmuskels durch einen Infarkt könnten zumindest teilweise repariert werden. Wer weiß, vielleicht werden auch Funktionen infolge von Rückenmarksverletzungen zumindest teilweise wiederherstellbar sein.
— JS